根据1984年通过的
《Hatch-Waxman》
法案
,美国仿制药申请ANDA(AbbreviatedNew Drug Application)
不需要递交临床前及临床数据来证明安全性和有效性
,但必须科学地证明仿制药和原研药是生物等效的
。
NCE的新药申请
(NewDrug application,
简称NDA)
获批上市4年后的第一天
,仿制药厂商可提交附带PIV声明的ANDA申请
,第1家申请并成功获得首仿药资格的
,可获得180天的市场独占保护
。在这一天提交申请的仿制药厂可以共享这180天的独占期
,而在这一天以前提交的ANDA申请都不会被受理
。不挑战专利的PI、PII和PIII声明则还要多等一年
,到NCE的5年数据独占期满才能够提交
;
二
、需要递交哪些文件
申请者可以根据FDA发布的两个文件来准备ANDA的资料
:
《ANDA Submissions – Contentand Format of
Abbreviated New Drug Applications》
《ANDA FILLING CHECKLI》
FDA建议采用电子递交的方式
,因为Officeof Generic Drugs(OGD)没有足够的空间来存放纸质的申报文件
。参考FDA发布的指南
《ProvidingRegulatory Submissions in Electronic
Format —Certain Human PharmaceuticalProduct Applications and Related
Submissions Using the eCTD Specifications》
,ANDA我们也都采取eCTD的格式来进行申请
。
Module 1
主要就是Administrative的信息,相关表格可以从FDA网站上下载http://www.fda.gov/AboutFDA/ReportsManualsForms/Forms/default.htm。
需要说明一下专利声明书
,申请者需要根据I.ANDA的仿制对象没有专利信息
;II,
专利已过期
;III,
专利将在某日过期
,IV,
专利无效
,或者本次ANDA不侵犯该专利
,撰写一份专利证明
,如若申请者想要挑战专利
,即第IV段声明
,仿制药申请者需要在提交ANDA的20天内通知原研药持有者
,原研药持有者可以在45天内向法院提交诉讼
,FDA对该ANDA的批准就自动延后30个月
。
Module 2 CTD Summaries, 主要包括2.3 QOS以及2.7 Clinical summary
(Bioequivalence); 基于药物质量评估的科学性和风险性的要求
,FDA开发并实施了一种QbR(Questionbased
Review)
的评审方法,申请者需要依据FDA提供的QbR的模板来撰写QoS。
Module 3 CMC部分
;
Module 4一般ANDA不需要提交本部分资料
;
Module 5 生物等效性研究资料
,这部分提交的信息是获得FDA批准的关键部分
,
一般是在健康人体中比较仿制药和orangebook中规定的RLD(参比制剂)的生物利用度来进行评价
,研究可能包括进食前后药品的生物利用度评价
。
三
、批准流程
ANDA是由CDER下属的仿制药办公室
(Officeof Generic Drugs)
审批的
,仿制药所参照的药品必须是在orangebook中的RLD。
仿制药生产公司需要在申报资料中证明其仿制的药品与RLD具有相同的活性成分
;同样的生产质量标准
,相同的剂型
,规格
,给药途径
,用法用量等
;标签说明书除必要调整外基本相同
,以及证明仿制药与RLD具有生物等效性
。
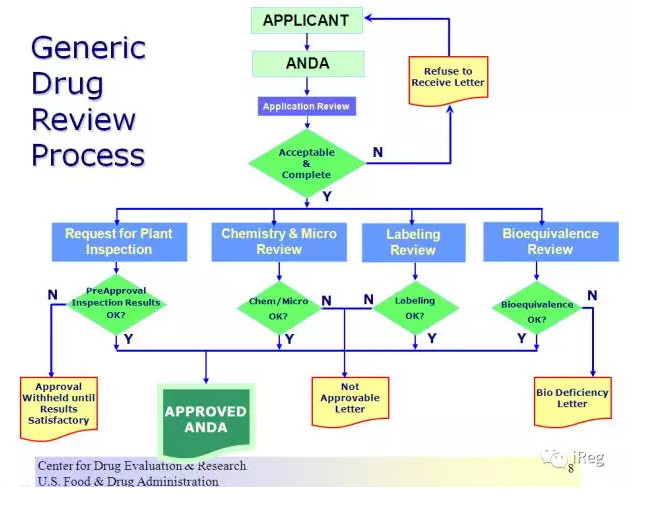
下图是仿制药审评流程:
ANDA中有四个关键审评点
:生物等效性审评
;药品的说明书审评
;化学/微生物审评
;以及工厂的现场检查
。其中
,生物等效性审评是关键所在
。
四
、批准时限
ANDA申请一旦提交
,FDA一般需在180天内进行审评
,给出批准approved、approvable或是notapprovable的通知
。