董主任
Tel.13583107361
| 技术转让-仿制药 一致性评价 |
|
董主任 |
Tel.13583107361 |
返回主页 |
| 美沙拉嗪 mesalazine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 化学结构式 |
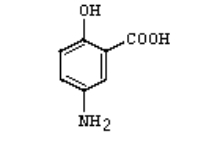
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 理化 |
Ph.Eur.6.8(Mesalazine)类白色、或浅灰色、或浅粉色的粉末或结晶。 USP33(Mesalamine)浅淡褐色至粉红色针状结晶,无臭或具轻微特殊臭,暴露于空气可加深颜色。 Ph.Eur.6.8(Mesalazine)极微溶于水;几乎不溶于乙醇。溶于氢氧化物的稀碱溶液和稀盐酸溶液。 USP33(Mesalamine)微溶于水;极微溶于无水乙醇、丙酮、甲醇;几乎不溶于丁醇、氯仿、二氯甲烷、乙醚、乙酸乙酯、正己烷及丙醇;溶于稀盐酸溶液和氢氧化物稀碱溶液。 pH值3.5-4.5。 pKa 4 logS 0.5 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 适应症 |
溃疡性结肠炎:既用于治疗急性发作,又用于避免治疗溃疡性结肠炎复发; 克罗恩病:用于治疗急性发作。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剂型 |
肠溶片 缓释片 肠溶颗粒 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 规格 | 0.25g 0.5g 0.7g 1.2g | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 用法用量 |
6岁及以上的儿童:儿童和青少年:儿童(6-18岁)的疗效有限。 急性发作:在以单独剂量施用30-50mg / kg体重/天的初始剂量之后,应该单独调整剂量。 最大剂量:75mg/kg体重/天。 总剂量不应超过最大成人剂量。 预防复发(溃疡性结肠炎):在分开剂量给予15-30mg / kg体重/天的初始剂量后,应该单独调整剂量。 总剂量不应超过推荐的成人剂量。一般建议给予成人剂量的一半,体重达40kg选用正常成人剂量。 每天早餐,午餐和晚餐1h前,伴足量的液体服用Salofalk 500mg。Salofalk 500mg治疗应在急性炎症阶段和长期治疗期间定期持续进行,只有这样才能达到理想疗效功。给药方法遵医嘱。溃疡性结肠炎,可将剂量降至1.5g美沙拉嗪/天(40kg体重的成人和青少年)或0.75g美沙拉嗪/天(儿童/青少年)用于预防复发。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 批准文号 | 美沙拉秦肠溶片国内生产批文三条(0.25g规格2个,0.4g规格1个),进口产品两个falk pharma(0.25g规格,0.5g规格各1个)。另外辉凌制药0.5g的缓释片也值得关注。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 项目简介 |
溃疡性结肠炎是一种病因尚未明确的非特异性慢性炎症性疾病。激素类药物、 5 - 氨基水杨酸类药物和免疫抑制药为治疗溃疡性结肠炎的三大类药物。随着医疗技术的进步, 临床研究发现,30% 的重症溃疡性结肠炎经激素治疗后病情并未得到有效改善,称为激素抵抗型溃疡性结肠炎,其治疗手段较复杂且病程较长、 预后较差。 美沙拉秦是近年来新发现的一种药,临床上主要用于治疗溃疡性结肠炎,尤其对肠壁内炎性结缔组织效果更佳。该药物能使肠管过氧化物酶失活,阻止白三烯、前列腺素等炎症性细胞因子的生成和释放,肠道自由基被清除,使受损肠道的刺激降低,进而可治疗肠管溃疡。美沙拉秦肠溶片只作用在回肠尾端和结直肠处,使该药不会在胃、十二指肠就过早的进入体内,从而使得回肠和结直肠内药物浓度较高,上消化道避免了药物的刺激。近 10 年来, 国外采用美沙拉秦治疗 UC 取得良好疗效,且不良反应少见。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶出 | 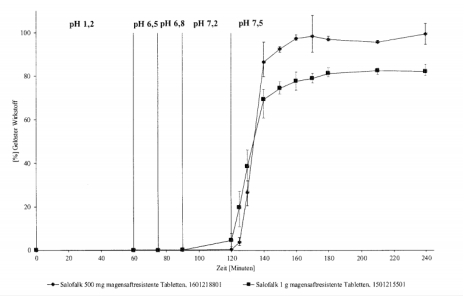 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 药代 |
BSC分类 4 吸收:美沙拉嗪的吸收在肠的近端和最低部位时最高。 代谢:美沙拉秦在肠粘膜和肝脏都被系统性地代谢为无药理活性的N-乙酰基-5-氨基水杨酸(N-Ac-5-ASA)。 乙酰化似乎独立于患者的乙酰化表型。 一定比例的美沙拉嗪也被结肠细菌乙酰化。 美沙拉嗪的蛋白质结合率是43%,N-Ac-5-ASA的蛋白质结合率是78%。 排泄:美沙拉嗪及其代谢物N-Ac-5-ASA通过粪便(主要部分),肾(根据应用类型,盖伦制剂剂型及其美沙拉嗪释放行为变化在20和50%之间)和胆汁(低比例)排除。 肾脏排泄主要以N-Ac-5-ASA的形式存在。约 1%的口服美沙拉嗪剂量主要以N-Ac-5-ASA的形式进入母乳。 (2)Salofalk 500mg的具体方面: 分布:结合药物显像/药代动力学研究显示,Salofalk 500mg肠溶片剂在大约3-4小时内到达禁食志愿者的回肠区域并且在约4-5小时内到达升结肠。 在结肠中的总运输时间约为17小时。 吸收:Salofalk 500mg肠溶片释放美沙拉嗪后,大约3-4小时的滞后时间开始。大约5小时后达到最大血浆浓度(回肠血管区域),并且在美沙拉嗪的稳态条件下在3×500mg美沙拉嗪/天时为3.0±1.6μg/ ml,代谢物N-Ac-5-ASA为3.4±1.6μg/ ml。 消除:多次服用美沙拉嗪和N-Ac-5-ASA 24小时的总肾排泄率约为60%(3×1 Salofalk 500mg,肠溶片剂,2天,第三天1片肠溶片剂=检查日)。美沙拉嗪在口服中的未代谢比例约为10%。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 参比 |
FDA橙皮书数据库中该药肠溶片剂500mg无参比制剂,仅1.2G和800mg有参比。 日本PMDA橙皮书数据库中该药肠溶片剂500mg无参比制剂,仅收录了颗粒剂和250mg普通片剂。日本PMDA药品数据库中该药物无500mg肠溶片剂产品。 欧盟药品上市信息:EMA数据库中该药物该药肠溶片剂500mg产品有6个。 国家药监局发布的仿制药参比制剂目录第十批中,明确规格美沙拉秦肠溶片的参比制剂为Dr. Falk Pharma GmbH的产品Mesalazine Enteric-coated Tablets/ Salofalk ,规格0.25g和0.5g;第十四批中,明确规格美沙拉秦缓释片的参比制剂为Ferring GmbH的产品Mesalazine Sustained-release Tablets/Pentasa,规格500mg;该药物其他规格仿制参比暂无。 根据以上信息,选择Dr. Falk Pharma GmbH的产品Mesalazine Enteric-coated Tablets/ Salofalk ,规格0.5g做为参比制剂进行研究。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 处方 |
alofalk 500mg肠溶片:碱式甲基丙烯酸丁酯共聚物(Eudragit E,Ph.Eur。)、硬脂酸钙(Ph.Eur。)、交联羧甲基纤维素钠、氢氧化铁(III)(E172)、甘氨酸、胶体二氧化硅、羟丙甲纤维素、聚乙二醇6000、甲基丙烯酸 - 甲基丙烯酸甲酯共聚物(1:1)(Eudragit L,Ph.Eur。)、微晶纤维素、碳酸钠、聚维酮K25、滑石粉、二氧化钛(E171)。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂质 |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||